Para ilustrar o conceito de diagrama de níveis de energia vamos considerar o caso do átomo de hidrogênio no modelo atômico de Bohr.
Segundo o modelo de Bohr, as energias possíveis para o átomo são dadas pela seguinte expressão:
En = − mZ2e4/8εo2h2 [n = 1, 2, 3, … ∞]
O número atômico do átomo de hidrogênio é Z = 1. Desse modo, com os valores numéricos:
εo = 8,85 × 10−12 F/m
h = 6,63 × 10−34 Js
e = 1,60 × 10−19 C
m = 9,11 × 10−31 kg
e fazendo uso também da relação:
1 J = 6,24 × 1018 eV
temos:
E1 ≈ − 13,54 eV
Desse modo, as energias associadas aos estados estacionários do átomo de hidrogênio podem ser escritas:
En ≈ − (13,54/n2) eV [n = 1, 2, 3, … ∞]
No modelo de Bohr, sempre que um átomo passa de um estado estacionário para outro, ele emite ou absorve radiação eletromagnética com freqüência:
ν = |ΔE|/h
em que |ΔE| representa o módulo da diferença Ef − Ei, entre a energia do átomo no estado final Ef e a energia do átomo no estado inicial Ei.
Se Ei > Ef, um fóton com energia hν é emitido pelo átomo.
Se Ei < Ef, um fóton com a mesma energia é absorvido.
O diagrama de níveis de energia é uma ajuda importante para a compreensão dos processos de emissão e de absorção de energia pelo átomo. Para o átomo de hidrogênio, no modelo de Bohr, o diagrama de níveis de energia é mostrado na figura.
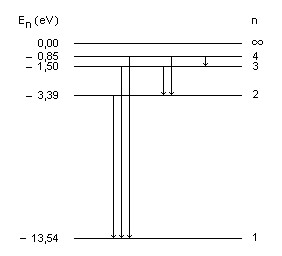
A dimensão vertical é usada para representar o valor da energia do estado estacionário. A cada estado estacionário, associamos uma linha horizontal. A separação entre duas linhas horizontais é proporcional a sua diferença de energia.
A energia potencial eletrostática do átomo é tomada como sendo nula quando a distância entre o elétron e o próton é infinita. Desse modo, os estados estacionários em que esse elétron e esse próton estão ligados com uma separação finita, constituindo um átomo de hidrogênio, têm energias negativas. Como todos os estados estacionários do átomo de hidrogênio têm energias negativas, a linha superior do diagrama de níveis de energia representa o estado de energia zero (n = ∞), correspondente ao próton e o elétron separados de uma distância infinita, ou seja, correspondente ao átomo ionizado.
A linha inferior representa o estado de menor energia, isto é, o estado no qual o elétron ocupa a primeira órbita de Bohr (n = 1, E1 ≈ − 13,54 eV). Esse estado é chamado estado fundamental do átomo de hidrogênio.
Os estados estacionários correspondentes às energias E2, E3 e E4 também estão representados. Os outros (infinitos) estados estacionários, cujas energias são maiores que E4 e menores que zero, não são mostrados.
Devido à forma desse diagrama, em que os estados estacionários são representados por linhas horizontais desenhadas em diferentes alturas conforme suas energias, isto é, em diferentes níveis horizontais, a expressão nível de energia se tornou sinônima da expressão energia de estado estacionário e também da expressão órbita estacionária.
Como níveis com n maiores têm maior energia, a transição de um estado de n maior para um estado de n menor vem acompanhada da emissão de um fóton, enquanto que a transição de um estado de n menor para um estado de n maior vem acompanhada da absorção de um fóton. É uma prática comum indicar as transições atômicas com flechas verticais no diagrama de níveis de energia, do nível inicial ao final. Na figura, apenas algumas transições estão indicadas.
Mesmo para o átomo de hidrogênio, que é a estrutura atômica mais simples, o diagrama de níveis de energia com base experimental ou gerado teoricamente pela Mecânica Quântica é bem mais complicado do que esse apresentado na figura acima.
